Las reacciones químicas suelen ir acompañadas de una transferencia de energía, especialmente en forma de calor, trabajo mecánico, energía eléctrica o energía luminosa. Dicha energía fluye, a veces, desde el seno de la reacción hacia el exterior; en otros casos, la energía debe suministrarse a la reacción para que ésta pueda producirse. El objetivo de la termoquímica no es únicamente el estudio de todas las formas de energía relacionadas con las reacciones químicas, sino la predicción de las condiciones en las cuales una reacción puede producirse.
Enlaces y energía.- Durante una reacción química los reactivos se fragmentan y reorganizan. Esto implica la ruptura de enlaces químicos y la formación de nuevos enlaces. Si la energía total de los enlaces finales es inferior a la de los enlaces iniciales, la reacción libera energía al medio. En caso contrario hay que absorber energía del medio para que la reacción se produzca
| Las reacciones que liberan energía al medio se denominan exotérmicas. Por el contrario, las que absorben energía son endotérmicas. |
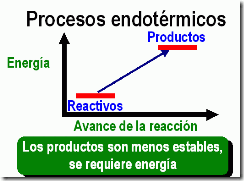 | 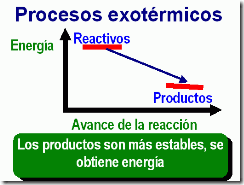 |
Energía de Gibbs.- Los principios de la termodinámica indican que el universo tiende hacia las situaciones con la menor energía posible. En el caso de las reacciones químicas, esto significa que las reacciones en que se desprende energía están más favorecidas. Pero ésta no es la única condición que se ha de cumplir.
El segundo principio de la termodinámica indica que los procesos más probables son los que tienden hacia el máximo desorden. para cuantificar estos dos factores se utiliza la energía libre de Gibbs. Un proceso será espontáneo cuando la energía de Gibbs disminuya.
Procesos espontáneos.- Si la única condición para que una reacción se produzca fuese que se desprendiera energía, serían muchísimos los procesos de nuestra vida cotidiana que no ocurrirían: el hielo no se fundiría, ni herviría el agua.
El mundo en que vivimos no obedece sólo al primer principio de la termodinámica. Consideremos las situaciones siguientes: una jeringa contiene gas; si se aumenta su volumen tirando del émbolo, el gas se distribuye de manera uniforme en el interior. Si mezclamos dos líquidos a distinta temperatura, el más caliente cede calor al frío y la temperatura final es la misma en todo el recipiente. En los anteriores ejemplos, la energía se conserva, aunque también se conservaría si se produjese el proceso contrario, es decir, que dentro de un líquido a una cierta temperatura, una parte se calentará y otra parte se enfriará o que el gas, dentro de un recipiente, fuera reuniendo todas las moléculas en un rincón.
El principio de conservación de la energía no justifica por sí solo que unos procesos ocurran en un sentido y no en el contrario. Todas estas situaciones se explican a partir del segundo principio de la termodinámica: un proceso ocurre de forma que tiende a la situación más probable, es decir, al máximo desorden. De acuerdo con éste, un gas está mucho más desordenado si sus moléculas ocupan todo el recipiente que si están todas juntas.
Respecto a las reacciones químicas, la dirección de su evolución será la que constituya un mejor balance entre la liberación de energía y la tendencia al máximo desorden. Podemos imaginar que cada sustancia tiene un contenido energético y un “orden” interno que dichas cantidades se combinan en la única magnitud (denominada energía libre). Si se comparan dichas cantidades para los reactivos y los productos de la reacción, podemos predecir si la reacción puede o no producirse. Un proceso será espontáneo cuando en él se produzca una disminución de la energía libre.
Las sustancias que intervienen en en una reacción tienen un contenido energético debido a la energía de las propias moléculas, átomos, núcleo o electrones. Las moléculas se trasladan, giran o vibran, los átomos se atraen entre sí en los enlaces químicos y los electrones se mueven en distintos orbitales alrededor de los núcleos. Cada una de estas situaciones tiene asociada una energía normalmente cinética (debida al movimiento) o potencial (debida a la posición). |